- 441
- 产品价格:面议
- 发货地址:湖北武汉江汉区 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:238597584公司编号:14192389
- 蒋小姐 商务代表 微信 180071419..
- 进入店铺 在线咨询 QQ咨询 在线询价
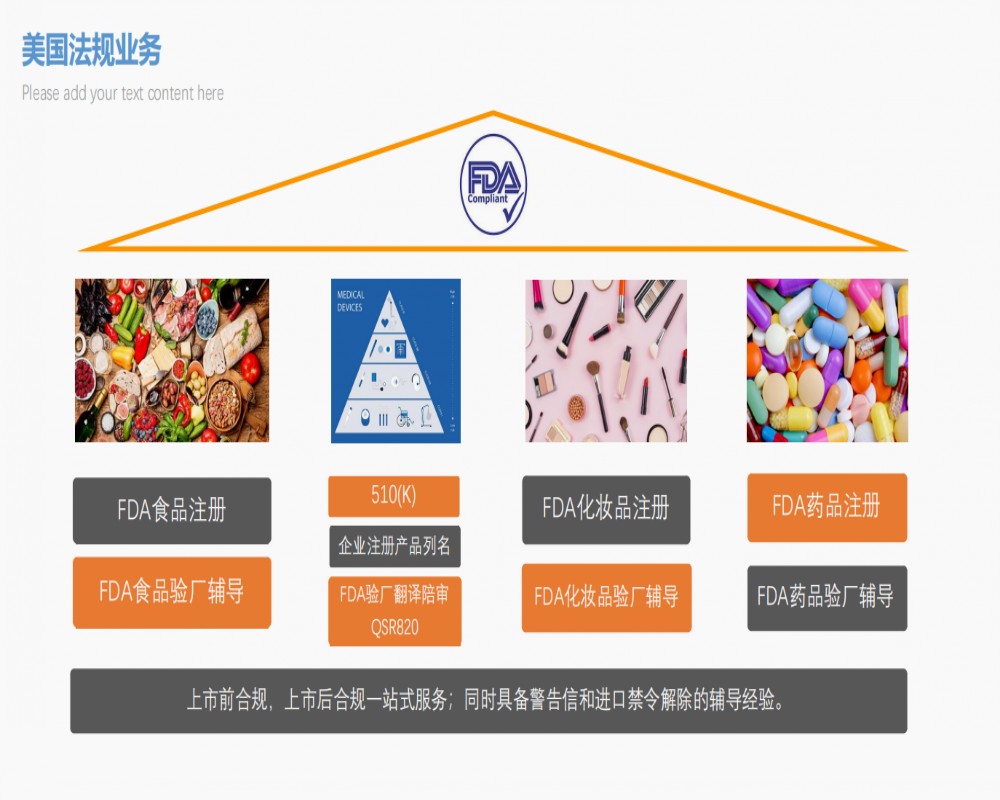
吴忠FDA验厂成功经验
- 相关产品:
近几年,在美国以外的市场,中国制造商的被抽样量一直稳居**位。目前中国在FDA的注册制造商约为4500家左右,每年抽查的概率在2-3%。通常FDA工厂审查会由1名审查官进行为期4天的现场审查。制造商*支付任何审查费用。
FDA验厂检查是美国FDA对医疗器械生产现场的调查。检查对象是所有在美国境内销售医疗器械的制造商,包括美国内和国外的制造商。由美国FDA派出检查官员到医疗器械实际生产场所,执行对工厂检查,以确定被检查的工厂是否符合QSR法规的要求。
FDA验厂审查重点:
1、评审文件( sampling);
2、QSIT方法(Quality System Inspection Technique)、4个主要子系统(Management, Design, CAPA, P&PC)、3个辅佐子系统(Documentation, Material, and Facility & Equipment Controls);
3、抱怨和投诉;
4、仓库;
5、测量设备;
6、卫生的特别要求;
7、特别过程,包括软件;
8、设计变更:工程变更,材料更改;
9、过程确认。
FDA验厂非常重视对生产记录的检查,对原材料的入库、检验及发放、生产工艺过程的控制、成品的质量检验以及各项重点项目的验证等均要求有完整的原始记录及整套的批记录, FDA官员在工厂检查要任意取样抽查批记录,批记录的真实性与完整性能具体体现工厂的GHP管理的水平。
FDA验厂的结果表示:
NAI表示在FDA工厂审查时,没有开出任何书面形式的不符合项(由于FDA的不合格报告表单的编号为483,FDA也将不符合简称“483”),也可以称为“零483”。
VAI表示在FDA工厂审查时,FDA审查官发现了工厂的管理系统有违背FDA的质量体系法规的内容,进而开具了书面形式的不符合项,也可以开具了“483”。“483”的个数可能是1个,也可能是20个或更多。只要工厂按照FDA的要求积整改,提供充分的证据,都不会导致更多后果。
OAI表示在FDA工厂审查时,FDA审查官发现了工厂管理系统存在严重违背FDA的质量体系法规的内容,或者是没有能够按照FDA的要求对于VAI进行及时充分的整改,而开具的警告信(Warning Letter)。如果仅仅是开具了警告信而没有上Import Alert,制造商的产品依然可以出口,但是警告信会公布在FDA网站上,会影响美国客户对制造商的信心,必须尽快采取措施解除。
我们公司将一如既往地奉行“诚信经营,精益求精” 的企业精神,竭诚相邀广大客户与我们携手并进,合作共赢。
联系电话是17717017570, 主要经营上海沙格医疗科技有限公司武汉分公司(咨询电话:18007141921)是一家QSR820验厂,主营:IVDR CE认证、MDR CE认证、英国UKCA认证、FDA产品测试、ISO13485体系认证等服务。十多年里,SUNGO已为全球30多家上市公司和全球制造商,合计5000多家企业提供过相关服务。。
单位注册资金单位注册资金人民币 100 万元以下。